축전지는 충전식 배터리라고도 하며, 여러 번 충전, 방전, 재사용할 수 있는 배터리의 한 종류입니다. 일회용 배터리는 한 번 사용 후 재충전이 불가능하지만, 축전지는 에너지 저장 용량을 회복시키는 충전 과정을 거칠 수 있는 장점이 있습니다.
축전지는 충전 및 방전 사이클 동안 가역적인 화학 반응을 기반으로 설계되었습니다. 축전지를 충전하면 전기에너
지가 화학에너지로 변환되어 배터리에 저장됩니다. 이 화학에너지는 축전지가 방전될 때 전기에너지로 방출될 수 있습니다. 여러 번 충전 및 방전할 수 있는 능력 덕분에 축전지는 일회용 배터리보다 비용 효율적이고 환경 친화적인 옵션입니다.
리튬 이온 배터리는 축전지의 한 예로, 휴대용 전자 기기(예: 스마트폰, 노트북), 전기 자동차 및 재생 가능 에너지 시스템 등 다양한 응용 분야에서 널리 사용됩니다. 리튬 이온 배터리는 용량이 크게 감소하기 전까지 수백 번, 심지어 수천 번까지 재충전이 가능합니다. 이로 인해 반복적인 충전 및 방전 사이클이 필요한 응용 분야에서 인기가 높습니다.
또 다른 예로는 자동차에 널리 사용되는 납축전지가 있습니다. 납축전지는 엔진이 작동하는 동안 차량의 발전기에 의해 충전되어 전기를 저장하고 엔진을 여러 번 시동할 수 있는 전원을 제공합니다. 이러한 배터리는 또한 무정전 전원 공급 장치(UPS)와 같은 백업 전원 시스템에서 반복적으로 충전 및 방전할 수 있어 안정적인 대기 전원을 제공합니다.
축전지는 일회용 배터리로 인한 폐기물을 줄이고 지속 가능한 에너지 사용을 촉진하는 데 중요한 역할을 합니다. 기술의 발전으로 축전지의 성능, 용량 및 수명이 지속적으로 향상되어 현대 에너지 저장 솔루션의 중요한 부분이 되고 있습니다.
예비 배터리는 활성 전극 물질이 전해질과 접촉하지 않거나 전해질이 고체 상태로 장기간 보관할 수 있도록 설계된 배터리의 한 종류입니다. 이 독특한 설계 덕분에 배터리는 여러 해에서 수십 년에 걸쳐 비활성 상태로 에너지를 보존할 수 있습니다. 배터리를 사용할 필요가 있을 때 전원 공급원이나 액체 전해질을 도입하여 활성화됩니다.
예비 배터리는 즉각적인 활성화가 필요하지 않지만, 장기적인 에너지 저장과 안정성이 중요한 상황에서 신뢰할 수 있는 전원을 제공하는 것이 목적입니다. 이러한 배터리는 군사, 항공우주, 비상 백업 시스템, 원격 감지 장치 및 장기간 보관 후에도 신뢰할 수 있는 전원이 필요한 기타 분야에서 사용됩니다.
리튬 티오닐 클로라이드(Li-SOCl2) 배터리는 예비 배터리의 실제 예입니다. 이 배터리는 리튬 양극과 티오닐 클로라이드 음극으로 구성됩니다. 이 배터리의 전해질은 고체 상태로, 저장 중 화학 반응과 에너지 손실을 방지합니다. 배터리를 활성화할 필요가 있을 때, 전원 공급원이나 주 배터리를 예비 배터리에 연결하여 전해질이 녹아 활성 상태로 들어가게 합니다. 이 활성화 과정을 통해 배터리는 효율적이고 신뢰할 수 있는 전원을 제공합니다.
예비 배터리는 긴 저장 수명, 낮은 자체 방전률 및 높은 에너지 밀도 면에서 큰 이점을 제공합니다. 이러한 배터리는 비상 조명 시스템, 전자 요금 징수 장치 또는 중요한 장비의 장기 보관과 같은 간헐적이거나 드문 전력 필요성이 있는 응용 분야에 적합합니다. 예비 배터리는 오랜 기간 에너지를 유지하면서도 필요할 때 활성화할 수 있는 능력 덕분에 다양한 전문 분야에서 신뢰할 수 있는 전원 공급 솔루션으로서 중요한 가치를 지닙니다.
배터리의 맥락에서 분리막은 전극 간의 직접적인 접촉을 방지하여 단락을 피하면서도 전해질을 통해 이온의 이동을 허용하는 중요한 구성 요소입니다.
분리막은 일반적으로 높은 다공성, 기계적 강도, 화학적 안정성 및 낮은 전기 저항과 같은 특성을 가진 다공성 재료입니다.
폴리에틸렌(PE) 또는 폴리프로필렌(PP) 막이 분리막 재료의 일반적인 예입니다. 이러한 재료는 리튬 이온 배터리, 납축전지 및 알칼리 배터리를 포함한 다양한 배터리 기술에서 널리 사용됩니다. 동시에 리튬 이온, 전해질 이온 또는 전기 화학 반응에 필요한 기타 이온 종의 이동을 허용합니다.
리튬 이온 배터리에서 분리막은 단락, 열 폭주 및 기타 안전 위험을 방지하는 데 중요한 역할을 합니다. 분리막은 리튬 금속 또는 기타 활성 물질의 고체 입자나 덴드라이트의 이동을 억제하는 물리적 장벽 역할을 하여 내부 단락을 방지하고 잠재적으로 배터리 고장 또는 열 폭주로 이어질 수 있습니다.
또한 분리막은 특정 재료로 표면 개질되거나 코팅되어 성능과 안전 특성을 향상시킬 수 있습니다. 예를 들어 세라믹 코팅 또는 첨가제는 분리막의 열 안정성 및 기계적 강도를 향상시켜 극한 작동 조건에서 열 폭주에 대한 추가적인 보호를 제공합니다.
화학 배터리 및 전해 커패시터의 맥락에서 전해질은 이온의 이동을 촉진하고 이러한 장치의 정상 작동을 가능하게 하는 매체를 말합니다. 전해질은 이온이 양극과 음극 사이를 이동할 수 있는 전도성 경로를 제공하여 장치의 기능에 필요한 전기 화학 반응을 완료합니다. 전해질은 이러한 화학 반응의 가역성을 유지하는 데 중요한 역할을 합니다.
배터리에서 전해질은 일반적으로 이동 이온을 포함하는 용액 또는 혼합물입니다. 이러한 이온은 배터리의 종류에 따라 양전하(양이온) 또는 음전하(음이온)를 가질 수 있습니다. 전해질은 전극 사이의 이온 흐름을 허용하며, 전극은 전기 화학 반응이 발생하는 장소입니다.
리튬 이온 배터리에 사용되는 전해질은 리튬 염(예: 리튬 헥사플루오로포스페이트 또는 리튬 퍼클로레이트)을 유기 용매(예: 에틸렌 카보네이트 또는 디메틸 카보네이트)에 용해한 것으로 구성됩니다. 배터리 작동 중 리튬 이온(Li+)이 전극 물질에서 방출됩니다. 이 리튬 이온은 전해질을 통해 이동하여 전극 물질과 상호 작용하며, 전기 에너지를 저장하고 방출하는 가역적인 반응을 촉진합니다.
전해 커패시터에서는 전해질이 전극 사이의 공간을 채우는 전도성 액체 또는 젤입니다. 전해질은 이온의 흐름을 허용하여 커패시터의 충전 및 방전을 가능하게 합니다. 커패시터의 전해질은 높은 이온 전도성과 낮은 저항을 갖도록 특별히 설계되어 효율적인 전하 전달을 보장합니다.
전해질 선택은 전기 화학 장치의 성능, 안전성 및 수명에 큰 영향을 미칠 수 있습니다. 이온 이동성, 용해성, 안정성 및 전극 물질과의 호환성과 같은 요소를 고려하여 특정 응용 분야에 적합한 전해질을 선택해야 합니다.
요약하자면, 전해질은 화학 배터리와 전해 커패시터의 정상 작동을 위해 필요한 이온을 제공하는 매체입니다. 전해질은 전극 사이의 가역적인 화학 반응을 가능하게 하여 전기 에너지를 저장하고 방출할 수 있게 합니다. 전해질의 구성 및 특성 최적화는 전기 화학 시스템에서 원하는 성능과 신뢰성을 달성하기 위해 중요합니다.
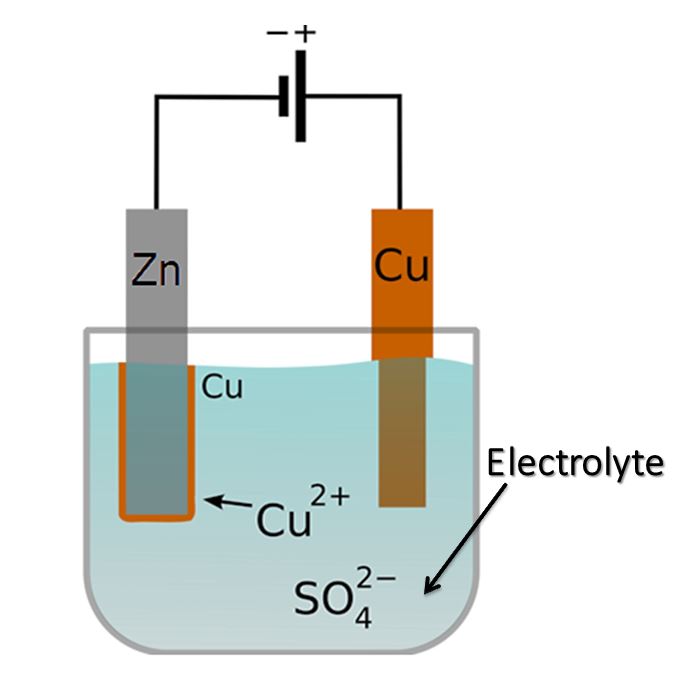
전해질 셀은 외부 전원 공급 장치와 회로를 형성하여 전기 화학 시스템을 통해 전류를 흐르게 하여 전기 화학 반응을 유도하는 전기 화학 장치입니다. 전해질 셀은 전류의 적용이 자발적이지 않은 화학 반응을 일으키는 원리를 기반으로 작동합니다.
전해질 셀은 전해질 용액에 담긴 두 개의 전극(양극과 음극)으로 구성됩니다. 양극은 양전하를 띠고, 음극은 음전하를 띱니다. 외부 전원 공급 장치가 셀에 연결되면 전위차를 제공하여 전해질 내의 이온 이동을 유도합니다.
전해 과정 동안 양이온(양전하 이온)은 음극으로 끌려가 전자를 얻고 환원 반응을 겪습니다. 반대로 음이온(음전하 이온)은 양극으로 이동하여 전자를 잃고 산화 반응을 겪습니다. 이러한 전기 화학 반응은 전극-전해질 접촉면에서 발생합니다.
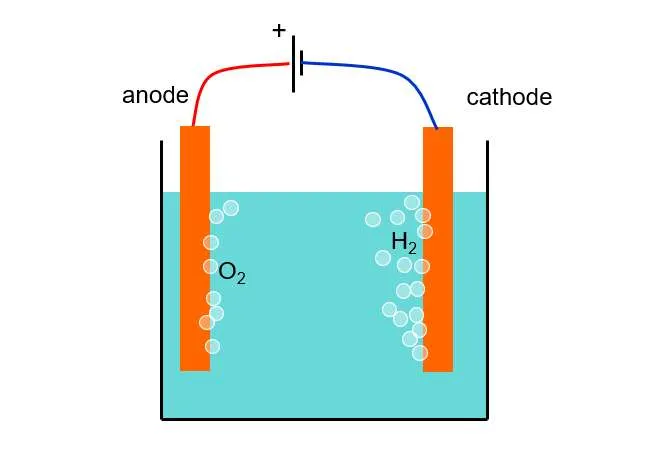
전해질 셀의 실질적인 예는 물의 전해입니다. 직류 전류가 물 전해질 셀을 통해 흐르면 물 분자(H2O)는 음극에서 수소 가스(H2)와 양극에서 산소 가스(O2)로 분해됩니다. 환원 반응은 음극에서 발생하며: 2H+ + 2e- → H2(g), 산화 반응은 양극에서 발생합니다: 2H2O → O2(g) + 4H+ + 4e-. 이 과정은 물을 그 구성 요소로 분리하는 것을 가능하게 합니다.
염, 산 또는 용융 금속과 같은 다양한 화합물의 전해도 전해질 셀에서 수행될 수 있습니다. 이러한 셀은 전기도금, 금속 정제, 소금물 전해를 통한 염소 및 수산화 나트륨 생산, 산화 알루미늄에서의 알루미늄 전해 생산 등의 다양한 응용 분야를 가집니다.
전해질 셀의 주요 특성에는 자발적이지 않은 반응을 유도하는 능력, 외부 전원 공급 장치에 대한 의존성, 이온 전도성 전해질에 의해 전극이 분리되는 것이 포함됩니다. 이들은 전기 화학 공정에 대한 정확한 제어를 가능하게 하며 다양한 산업 및 과학 응용 분야를 제공합니다.
요약하면, 전해질 셀은 외부 전원 공급 장치를 이용하여 전해질을 통해 전류를 강제하고 자발적이지 않은 화학 반응을 유도하는 전기 화학 장치입니다. 그 원리와 특성을 이해함으로써 전해질 셀은 전해, 전기도금, 산업용 화학 생산 등의 다양한 분야에 적용될 수 있습니다.
이온 교환 막은 이온성 기질을 포함한 고분자 막으로, 용액 내에서 특정 이온을 선택적으로 전달할 수 있습니다. 이 막은 전해 분리, 전기 침전, 연료 전지 및 이온 교환 시스템을 포함한 다양한 전기 화학 공정에서 중요한 역할을 합니다.
이온 교환 막의 원리는 전하와 크기에 따라 이온의 선택적 통과를 촉진하는 능력에 있습니다. 이 막은 일반적으로 플루오로화된 고분자나 스펀폰화된 고분자와 같은 고분자 매트릭스로 구성되며, 이온과 상호 작용할 수 있는 기능성 그룹을 포함하고 있습니다.
이온 교환 과정은 다양한 이온을 포함한 용액이 막과 접촉할 때 발생합니다. 막 내의 이온성 기질은 반대 전하를 띤 이온들을 끌어들여 이들이 막을 통과하도록 유도하며, 동시에 동일 전하를 띤 이온들의 통과를 차단합니다. 이 선택적 이온 전송은 용액 내의 특정 이온을 분리, 정제 또는 농축하는 것을 가능하게 합니다.
이온 교환 막의 실질적인 예로는 연료 전지에서 널리 사용되는 나피온(Nafion) 막이 있습니다. 나피온은 고 프루오소화된 산성 고분자로, 높은 프로톤 전도성을 나타냅니다. 연료 전지에서 이온 교환 막은 양극에서 음극으로 프로톤(H+)을 전송하고, 전자의 통과를 차단하여 전기화학 반응을 통해 전기를 생성할 수 있게 합니다.
이온 교환 막은 물의 염 제거 공정인 전기 침역에서도 응용됩니다. 이 공정에서 이온 교환 막은 공급 용액을 두 개의 구획으로 나누어, 막의 특성에 따라 양이온이나 음이온이 선택적으로 통과하도록 합니다. 전기장을 가하여 이온을 용액에서 제거함으로써, 물의 염 제거 또는 정화가 가능해집니다.
이온 교환 막의 주요 특성에는 이온 선택성, 높은 이온 전도성, 기계적 안정성, 화학 저항성 및 내구성이 포함됩니다. 이 막들은 고분자 매트릭스 내의 이온성 그룹의 종류와 농도를 조절함으로써 특정 응용에 맞게 맞춤화될 수 있습니다.
이온 교환 막은 이온의 전하와 크기에 따라 선택적으로 전송되는 고분자 막으로, 이 선택적 이온 전송을 통해 이온 교환 막은 이온 분리, 정제 및 농축을 위해 다양한 전기 화학 공정에서 활용됩니다. 그들의 이온 선택성, 전도성 및 내구성은 연료 전지, 물의 염 제거 및 이온 교환 시스템과 같은 기술에서 필수적인 구성 요소로 만듭니다.
고체 전해질 상호작용(SEI)은 배터리의 초기 충전 및 방전 주기 동안 전극 물질과 전해질 사이의 고체-액체 인터페이스에서 형성되는 얇은 보호층을 의미합니다. 이는 리튬이온 배터리에서 중요한 구성 요소로 작용하며, 배터리의 성능, 안정성 및 안전성에 중대한 역할을 합니다.
SEI 층의 형성은 전극 물질과 전해질 구성 요소 간의 반응에 의해 일어납니다. 이 반응은 전해질 용매 및 첨가제의 환원과 전해질 염의 분해를 포함할 수 있습니다. SEI 층은 주로 이러한 반응에서 생성된 유기 및 무기 화합물로 구성되어 있습니다.
SEI 층은 전극 물질을 덮고 전극과 전해질 간의 추가 반응을 방지하는 보호 필름 역할을 합니다. 이는 전극과 전해질 간의 직접적인 접촉을 줄이는 장벽 역할을 하여 부차 반응을 최소화하고 배터리의 안정성을 향상시킵니다.
SEI 층은 전기 절연성을 가지고 있어 전자의 통과를 방지하며 전극-전해질 인터페이스에서의 부수적 반응을 줄입니다. 그러나 리튬 이온의 이동을 허용하여 배터리 작동을 위한 원하는 전기화학 반응을 가능하게 합니다.
SEI 층의 구성과 특성은 전극 물질의 종류, 전해질 조성, 주기 조건 및 배터리 화학 등 여러 요소에 따라 달라집니다. SEI 층의 형성과 진화는 배터리의 성능, 용량, 주기 안정성 및 안전성에 중요한 영향을 미칩니다.
그래핀을 아노드 물질로 사용하는 리튬 이온 배터리에서 SEI 층의 실질적인 예는 초기 주기 동안 전해질이 그래핀 표면과 반응하여 주로 리튬 탄산염 (Li2CO3), 리튬 산화물 (Li2O) 및 기타 유기 화합물로 구성된 안정적인 SEI 층을 형성하는 것입니다.
SEI 층은 영구적이지 않으며, 지속적인 주기와 배터리의 노화로 인해 시간이 지남에 따라 변화할 수 있습니다. 이로 인해 화학적 및 구조적 변화가 일어날 수 있으며, 이는 그 두께와 구성의 변화 또는 열 분해로 이어질 수 있습니다. SEI 층의 형성과 행동의 이해와 통제는 성능 향상, 수명 연장 및 안전성을 갖춘 고급 배터리 기술 개발에 중요합니다.
요약하면, SEI는 주로 리튬 이온 배터리에서 형성되는 고체-액체 인터페이스의 보호층을 의미하며, 전극 물질을 전기 절연시키면서도 리튬 이온의 이동을 가능하게 합니다. SEI 층의 구성과 특성은 배터리의 성능과 안정성에 중요한 영향을 미치며, 이는 배터리 연구 및 개발의 중요한 측면입니다.
Seoul: NEWARE
1314 ,Gasan Digital 2-ro 70, Geumcheon-gu, Seoul 19th Taerung Techno Town, Gasan-dong, Geumcheon-gu, Seoul , Korea 08589


