순환 전압법(CV)은 전극/전해질 계면에서의 전기화학 반응의 거동, 동역학, 속도 결정 단계를 연구하는 기술적 방법입니다. 이 방법은 테스트가 간단하고 반응 속도가 빠르며, 순환 전압 그래프에서 얻을 수 있는 풍부한 정보를 제공합니다. 순환 전압법은 재료 과학, 화학, 환경 과학 및 생화학 분야에서 광범위하게 응용됩니다. 특히, 전기화학 분야의 지식과 기술 발전을 촉진하는 데 필수적인 역할을 합니다. 순환 전압법을 통해 전극의 가역성, 전극 반응 메커니즘을 결정하고, 전기화학 실험에서 정량 분석을 수행할 수 있습니다.
순환 전압법(CV)은 전극 표면에 선형적으로 변하는 전위(전압)를 적용하고 그에 따른 전류 반응을 모니터링하여 전기화학 반응의 동역학과 메커니즘을 연구하는 전기화학 분석 기술입니다. 이 방법은 전극 전위를 제어하고, 전위 변화 동안 전극을 통해 흐르는 전류를 기록하여 전류-전위(i-E) 곡선 그래프를 생성하는 방식으로 이루어집니다.
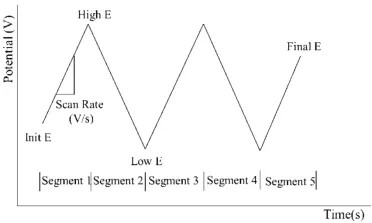
순환 전압법의 자극 신호 다이어그램
순환 전압법 측정에서 일반적으로 3전극 시스템이 사용됩니다. 3전극 시스템을 사용하는 이유는 폴라리제이션 중에 작업 전극과 보조 전극의 전위가 변하기 때문입니다. 또한, 작업 전극과 보조 전극 사이의 용액에서 발생하는 폴라리제이션 전류에 의한 오믹 전위 강하가 측정된 전극 전위에 중첩되어 테스트 결과에 영향을 미칠 수 있습니다.
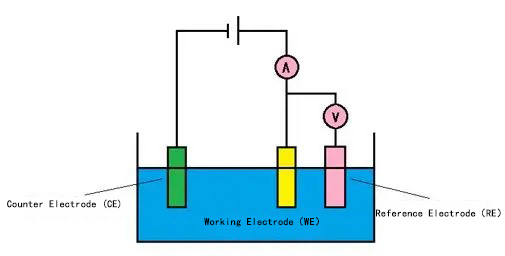
삼전극 시스템
순환 전압법에서는 전위가 초기 값에서 시작하여 일정한 스캔 속도로 설정된 최종 전위까지 선형적으로 증가한 후, 이를 반전시켜 초기 전위로 돌아가면서 완전한 사이클을 형성합니다. 이 과정은 여러 번 반복하여 전기화학 반응에 대한 자세한 정보를 얻을 수 있습니다. 얻어진 순환 전압도그램을 분석함으로써, 산화환원 피크, 피크 전위, 피크 전류 및 반응의 가역성에 대한 중요한 정보를 얻을 수 있습니다.
순환 전압법에는 일반적으로 다음과 같은 주요 특징이 포함됩니다.
● 피크 전류: 이는 특정 전위에서 산화환원 반응의 속도를 나타내며, 피크의 크기는 반응 속도 및 분석물의 농도와 관련이 있습니다.
순환 전압도그램에서 얻을 수 있는 몇 가지 중요한 매개변수는: 양극 피크 전류 (ipa), 음극 피크 전류 (ipc), 양극 피크 전위 (Epa), 음극 피크 전위 (Epc)입니다. 피크 전류 ip를 측정하는 방법은: 기준선을 따라 접선을 그리고 이를 피크 기저로 외삽한 후, 피크 꼭짓점에서 접선으로 수직선을 그립니다. 그들 사이의 높이가 ip입니다. Ep는 피크 꼭짓점에 해당하는 수평축에서 직접 읽을 수 있습니다.
● 피크 전위: 산화 피크와 환원 피크의 전위로, 이를 통해 특정 산화환원 반응을 식별할 수 있습니다.
순환 전압도그램에서 환원 피크는 음극 반응에 해당하며, 전류는 음극 전류입니다. 해당 피크는 환원 피크로, 피크 전위가 더 긍정적일수록 피크 전류가 커지고 환원이 더 쉬워집니다. 반면, 산화 피크는 양극 반응에 해당하며, 전류는 양극 전류입니다. 해당 피크는 산화 피크로, 피크 전위가 더 부정적일수록 피크 전류가 커지고 산화가 더 쉬워집니다.
● 전류 피크 분리: 두 피크가 잘 분리되어 있다면, 이는 두 반응이 다른 동역학적 특성을 가짐을 나타내며, 이를 통해 서로 다른 산화환원 과정을 구분하는 데 도움이 됩니다.
● 사이클 수: 전위가 초기 전위에서 시작하여 설정된 전위 범위를 지나 다시 초기 전위로 돌아오는 전체 과정을 완료하는 횟수입니다. 사이클 수는 전기화학 반응에 대한 자세한 정보를 얻고, 반응의 동역학적 특성을 이해하는 데 매우 중요합니다. 여러 사이클의 전압도그램을 관찰함으로써, 반응의 가역성과 안정성을 평가할 수 있습니다.
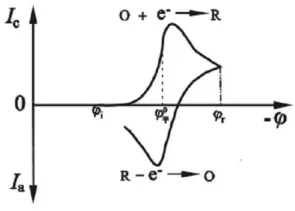
순환 전압법 전압-전류 반응 곡선
(1) 전극 반응의 가역성 결정
가역적인 전극:
a. 순환 전압도그램의 양의 스캔 단계와 음의 스캔 단계에서의 전류-전압 곡선이 형태가 대칭적입니다.
이때, 피크 전류는 같으며: Ipc = Ipa. 만약 원래 존재하던 피크가 사라지거나 새로운 피크가 생성되면, 이는 전극 인터페이스에서 비가역적인 반응이 발생했음을 나타냅니다.
b. 양극 피크 전위와 음극 피크 전위 사이의 차이가 작습니다.
피크 전위 차이: Δφ = φpa - φpc = 2.22RT/nF (mV); T = 25°C일 때, Δφ = 55.6/n (mV)
c. 스캔 속도를 변경해도 피크 전위에는 영향을 미치지 않으며, 이는 스캔 속도와 독립적입니다.
비가역적인 전극:
a. 일반적으로 단일 피크가 존재하며, 반전 스캔 피크가 없거나 양의 곡선과 음의 곡선이 비대칭적이며, 피크 전류 Ipc와 Ipa의 비율이 1보다 크거나 작습니다.
b. 양극 피크 전위와 음극 피크 전위 사이의 차이가 클수록, 비가역성의 정도가 커집니다.
c. 스캔 속도를 변경하면, E가 V와 함께 이동하며, 피크 전위는 스캔 속도에 의해 큰 영향을 받습니다.
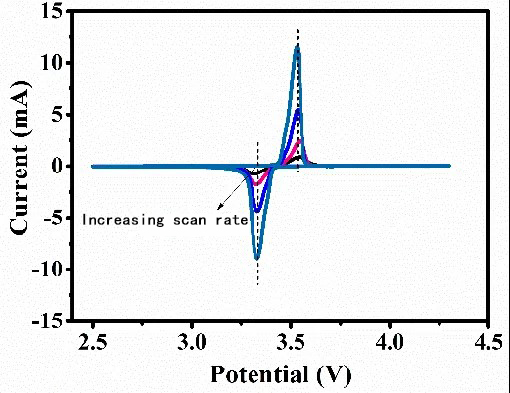
평형 전기화학 시스템의 CV 곡선
준가역적 과정:
피크의 형태, 피크 전위, 피크 전류는 전이된 전하의 수, 온도, 반응물/생성물 농도-확산 등뿐만 아니라, 전위 스캔 속도와도 관련이 있습니다. 일반적으로 스캔 속도가 증가하면, 준가역적 전기화학 반응에서 산화 피크와 환원 피크 사이의 전위 차이 Δφ가 점차 증가하게 됩니다(아래 그림 참조). 그러나 완전히 가역적인 전기화학 시스템에서는 이러한 상황이 존재하지 않습니다. 그림 4에서 보듯, 스캔 속도의 증가에 따라 산화 피크와 환원 피크의 전위는 본질적으로 변하지 않습니다.
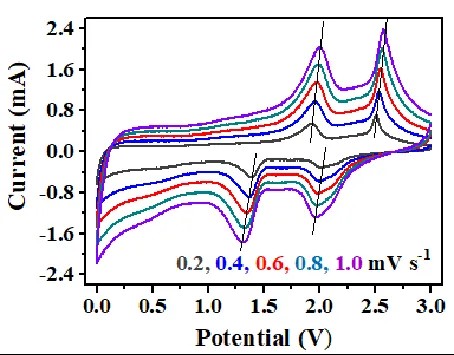
준평형 전기화학 시스템의 CV 곡선
(2) 전극 과정의 본질 연구
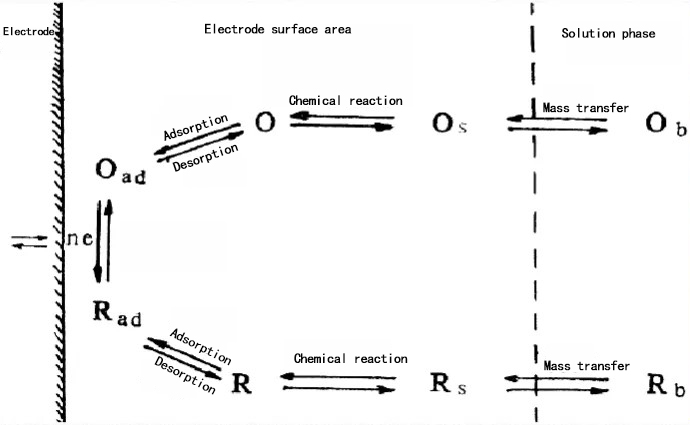
전극의 제어 단계: 전기 활성 물질은 먼저 확산 과정을 거쳐 전극 표면에 도달한 후, 흡착 과정을 통해 전극 표면에 흡착되어 반응에 참여합니다. 이 두 개의 연속적인 과정은 더 느린 과정에 의해 제어됩니다. 예를 들어, 확산 과정이 느리다면 그것이 전체 반응의 제어 과정이 됩니다.
전극 과정 제어의 메커니즘: 산화 피크 또는 환원 피크의 피크 전류가 스캔 속도와 직선적으로 비례하는 경우, 이는 전극 과정이 주로 동역학적 반응에 의해 제어된다는 것을 나타냅니다. 피크 전류가 스캔 속도의 제곱근과 직선적인 관계를 보일 경우, 전극 과정은 주로 확산에 의해 제어된다는 것을 의미합니다.
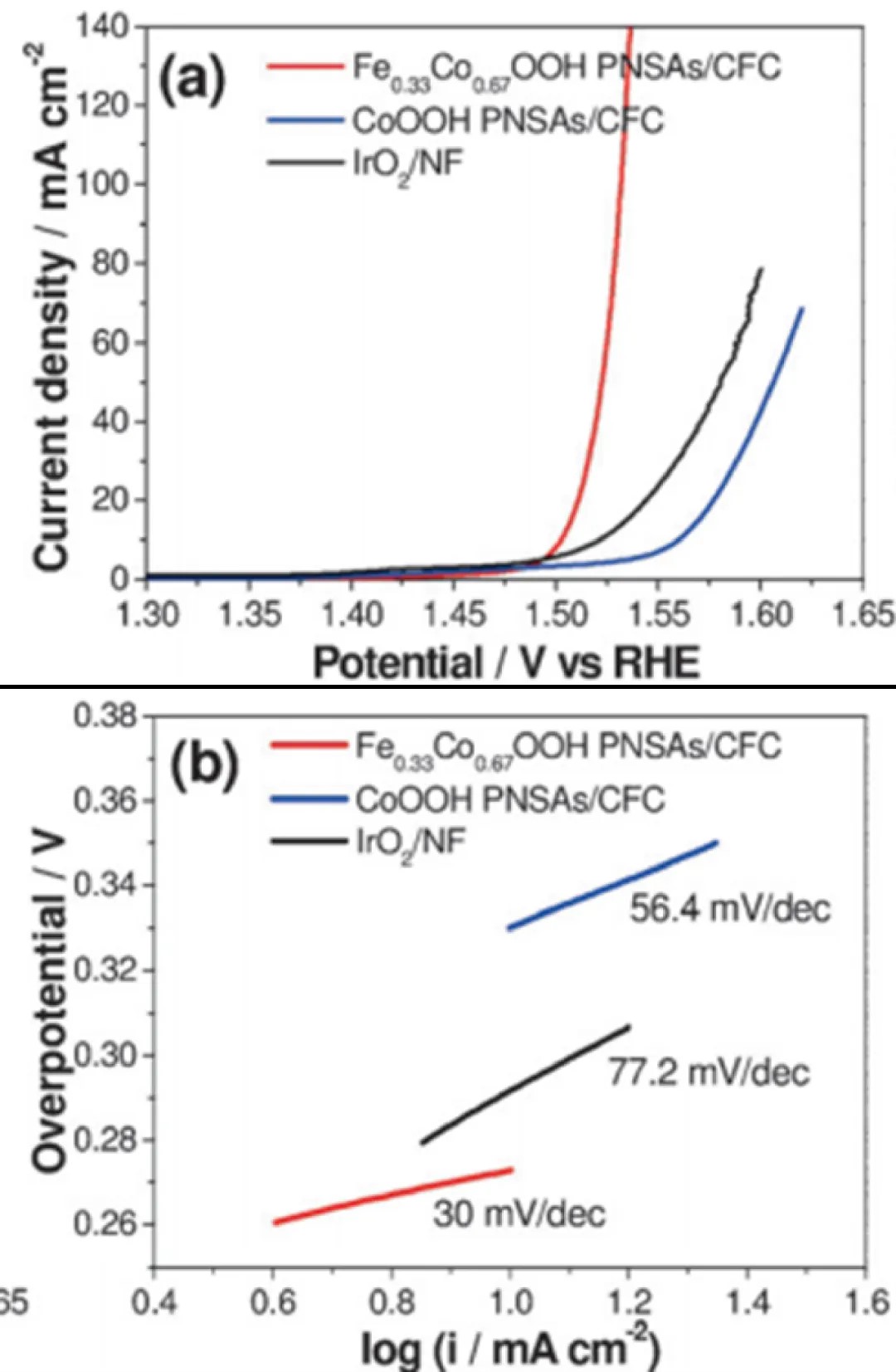
아래 그림은 세 가지 촉매가 촉진하는 산소 발생 반응(OER)의 선형 스캔 곡선과, 서로 다른 금속 화합물의 산소 흡착 촉매화 및 변환을 통해 얻어진 Tafel 곡선을 보여줍니다. Tafel 기울기가 작을수록 다전자 전달 반응의 속도 결정 단계가 뒤에 위치함을 의미하며, 이는 보통 좋은 전기촉매의 징후입니다. 세 가지 촉매 중 Fe0.33Co0.67OOH PNSAs/CFC 샘플이 가장 작은 Tafel 기울기를 보여주며, 이는 전류 밀도가 더 빠르게 증가하고 과전압(η)의 변화가 적음을 나타내며, 또한 그 우수한 전기촉매 성능을 나타냅니다.
순환 전압법 실험에서, 물질은 전극에서 뚜렷한 산화 피크 전류를 나타내며, 특정 농도 범위 내에서 물질의 산화 피크 전류는 그 농도와 선형적으로 관계가 있습니다. 따라서 주어진 지점에서 물질의 산화 피크 전류를 바탕으로, 선형 관계를 이용해 물질의 농도를 유추할 수 있으며, 이를 통해 물질의 함량을 계산할 수 있습니다. 이 방법은 일반적으로 미량 분석 및 중간 생성물의 식별에 사용됩니다.
Seoul: NEWARE
1314 ,Gasan Digital 2-ro 70, Geumcheon-gu, Seoul 19th Taerung Techno Town, Gasan-dong, Geumcheon-gu, Seoul , Korea 08589


